
CUY21为全球的转基因研究开创了诸多全新方向。最新款CUY21EDITII采用先进的脉冲芯片控制技术,BEX的多步脉冲、反向脉冲及恒流脉冲转化模式,无需任何专用试剂,提供高效高存活率的转化。
细胞的高效转染,尤其适合于原代细胞、免疗细胞、干细胞等难转染细胞的高效高存活率转化
在体/离体受精卵CRISPR/Cas9高效基因编辑
体内基因转染(in-utero,in-vivo,in-ovo)
体外基因转染(ex-ovo,ex-vivo)
贴壁细胞基因转染
1.先进组合脉冲技术,针对不同样品皆可提供完美的转化效果,真正一机多能。
高压瞬时穿孔脉冲+低压导入脉冲(动态衰减/静态衰减)+反转脉冲。主要用于悬浮和贴壁细胞的基因转染。
1.2 Square(V)方波电压模式:
释放方波脉冲,主要用于活体转基因。
1.3 Sauare(mA)恒流方波模式:
恒流脉冲是突破性的脉冲技术,可满足极其脆弱组织或细胞的高效基因转染。
小鼠在体受精卵CRISPR/CAS9基因编辑是目前全新的研究方向,利用恒流转化模式可以获得高生存率和高转化效率的实验结果。
2.无需任何额外的转染试剂
3.大屏幕直观设定转化参数,并实时监测显示实际实验数据
CUY21EDIT II独有的恒流转化模式,发明了受精卵在体输卵管转化(i-GONAD法)。这一方法的出现,较之上面的离体受精卵基因编辑方法又有了突破性进展。
应用案例
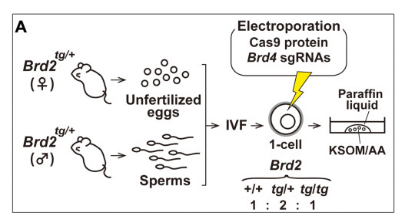
为了鉴定参与外胚层谱系形成的BET蛋白,我们分析了缺乏Brd4、Brd2和双突变体的突变胚胎。只有在Brd4/Brd2双缺陷桑椹胚中,NANOG阳性外胚层细胞的消失才明显。因此,JQ1处理的胚胎的表型不是通过Brd4-或Brd2单缺陷而复制的,而是仅通过Brd4/Brd2双缺陷复制的,证明了Brd2和Brd4在外胚层谱系的重要作用[1]。
为了获得基因敲除胚胎,使用CUY21 EDITII、GE-101铂板电极(长10 mm,宽3 mm,高0.5 mm,间隙1 mm)和GE-1电极夹(日本东京BEX有限公司)对Brd2tg/tg卵母细胞进行电穿孔得到。
CUY21EDITII电转仪通过对外泌体囊泡施加适当的电流击穿形成囊泡微孔,药物通过形成微孔加载到外泌体中,外泌体膜随后会很快恢复完成封装。CUY21EDIT II独特的动态衰减脉冲技术及恒流电阻测定技术使转染过程中电流输出更稳定,从而高效封装药物载入外泌体中。
应用案例
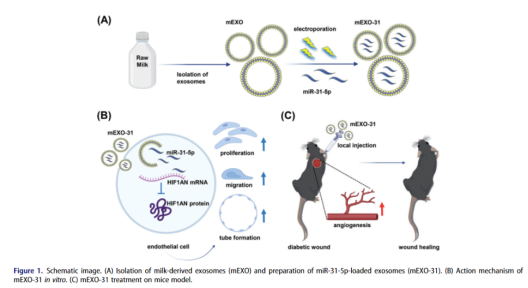
MicroRNA(miRNA)是关键生物过程中基因表达的重要调节因子,是糖尿病伤口治疗领域的一种有前景的核酸药物。在Chengqi Yan等人的研究中使用牛奶来源的外泌体作为miR-31-5p递送的新系统,并通过CUY21EDIT II (BEX, Japan) 电转仪电穿孔成功地将miR-315P模拟物封装到牛奶外泌体内。该研究证明了加载在外泌体中的miR-31-5p实现了更高的细胞摄取并能够抵抗降解并且miRNA-外泌体在体外显著改善了内皮细胞功能,同时在体内促进血管生成和增强糖尿病伤口愈合[2]。
应用案例
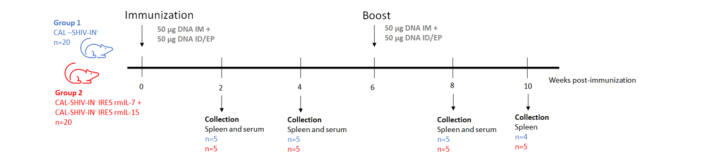
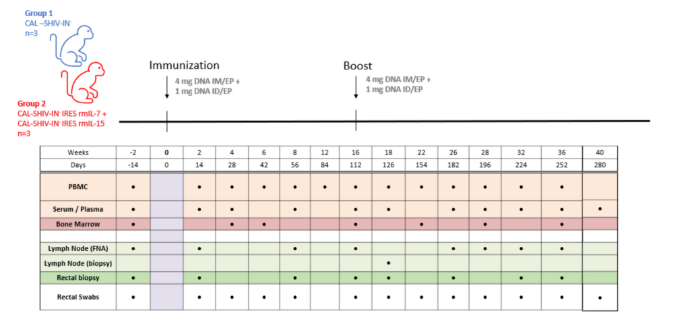
尽管存在有效的抗病毒治疗,但没有治愈或预防性疫苗,HIV-1仍然是世界范围内的一个主要公共卫生问题。病毒感染与宿主特异性免疫的许多逃逸机制有关,而且保护的相关性仍然不完全清楚。受减毒活病毒疗效的启发,Leroy等人已经开发了一种创新的DNA 疫苗 CAL-SHIV-IN-IRES IL-7和 CAL-SHIV-IN-IRES IL-15。
我们将两种DNA 疫苗 CAL-SHIV-IN-IRES IL-7和 CAL-SHIV-IN-IRES IL-15通过皮内注射+电穿孔(使用CUY21EDIT II (BEX, Japan) 电转仪和 10 mm 直径的LF567电极进行电穿孔)以及肌肉注射 (IM)联合免疫BALB/cJ 小鼠和恒河猴,检测两种共同注射的DNA 疫苗在小鼠和恒河猴体内的免疫原性,并将免疫应答与亲本疫苗 CAL-SHIV-IN-产生的免疫应答进行了比较。这种联合免疫在小鼠和恒河猴体内都引发了有效的疫苗特异性 CD4和 CD8T 细胞。免疫后40周,恒河猴的血浆和粘膜隔室均检测到 ADCC作用(ADCC)抗体,并被细胞因子增强[3]。
参考文献:
[1] Tsume-Kajioka M, Kimura-Yoshida C, Mochida K, Ueda Y, Matsuo I. BET proteins are essential for the specification and maintenance of the epiblast lineage in mouse preimplantation embryos[J]. BMC Biol, 2022,20(1):64-70.
[2] Yan C, Chen J, Wang C, et al. Milk exosomes-mediated miR-31-5p delivery accelerates diabetic wound healing through promoting angiogenesis[J]. Drug Deliv, 2022,29(1):214-228.
[3] Leroy LA, Mac Donald A, Kandlur A, Bose D, Xiao P, Gagnon J, Villinger F, Chebloune Y. Cytokine Adjuvants IL-7 and IL-15 Improve Humoral Responses of a SHIV LentiDNA Vaccine in Animal Models[J]. Vaccines (Basel), 2022, 10(3):461-483.

